 |

 |
 |
 |
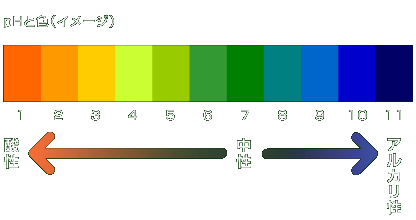
pHは、溶液中の水素イオン(H )濃度の割合を表すもので、H )濃度の割合を表すもので、H 濃度が大きいとpH数値が小さくなり、H 濃度が大きいとpH数値が小さくなり、H 濃度が小さいとpH数値が大きくなります。 濃度が小さいとpH数値が大きくなります。
例えば、H 濃度=0.01のときpH=2(酸性)、H 濃度=0.01のときpH=2(酸性)、H 濃度=0.0000001のときpH=7(中性)、H 濃度=0.0000001のときpH=7(中性)、H 濃度=0.00000000001のときpH=11(アルカリ性)となります。 濃度=0.00000000001のときpH=11(アルカリ性)となります。
酢酸ナトリウムと酢酸の入った水溶液は、次の化学式で表されます。
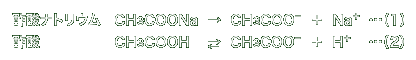
ナトリウム(Na)は、水溶液中でほぼ完全にナトリウムイオン(Na )になって溶けています。また、酢酸は一部だけが解離して、水素イオン(H )になって溶けています。また、酢酸は一部だけが解離して、水素イオン(H )と酢酸イオン(CH3COO )と酢酸イオン(CH3COO )になりますが、酢酸分子(CH3COOH)と平衡状態を保って溶けています。 )になりますが、酢酸分子(CH3COOH)と平衡状態を保って溶けています。
「平衡状態」とは、(2)式で、右側(→)に反応するスピードと左側(←)に反応するスピードがつりあっていて、溶液中の酢酸(CH3COOH)、酢酸イオン(CH3COO )、水素イオン(H )、水素イオン(H )の割合が一定に保たれている状態です。 )の割合が一定に保たれている状態です。
ここに、少量のHCl(HCl → H + Cl + Cl )が加えられても、一定の割合を保つように左側(←)に反応が進みます。このため、ほとんどH )が加えられても、一定の割合を保つように左側(←)に反応が進みます。このため、ほとんどH 濃度は変わりません。つまり、pHは塩酸を加える前とほとんど変わりません。このような性質を持った溶液を「緩衝溶液(バッファー)」と言います。 濃度は変わりません。つまり、pHは塩酸を加える前とほとんど変わりません。このような性質を持った溶液を「緩衝溶液(バッファー)」と言います。
一方、蒸留水に加えた塩酸はほぼ完全に解離しています。

そのため、加えた塩酸の量に応じて、H 濃度が大きくなります。 濃度が大きくなります。
したがって、答えは「Aに塩酸を加えた溶液の方が、Bに塩酸を加えた溶液よりもpHが小さくなる」となります。 |
|
 |
 |
|

 |


