
本シリーズでは、NMRの原理から実例までをできるだけ分かりやすくご紹介したいと思います。前回の 【原理編】 に引き続き、今回は【測定・解析編】です。
NMRチャートから得られる情報
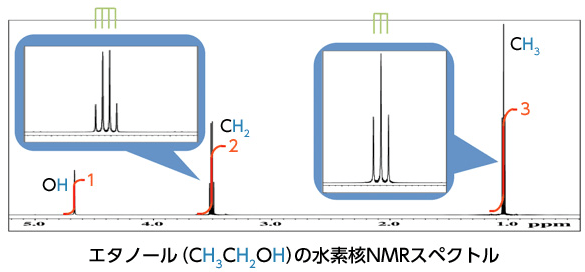
JEOL RESONANCEのページ より引用
フーリエ変換後のNMRチャートから得られる情報は、大きく分けて以下の3つです。
- 化学シフト(δ)
- カップリングとスピン結合定数(J)
- ピーク面積
以下、それぞれ何を表しているかを説明します。
1. 化学シフト(δ)
原子核の周りは、電子雲で囲まれています。電子も負電荷を持っていますので、外部磁場 B 0 がかかっている状態で原子核の周りを循環すると、反対向きの誘起磁場 B’ を生じます。
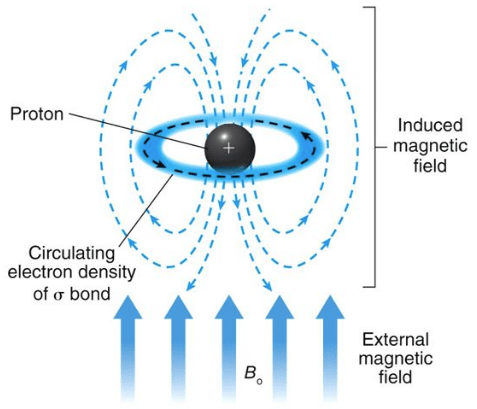
こちらのスライド より引用
原子核が感じる有効磁場 B はその分だけ減少し、
B = B 0 – B’
と表されます。これを電子による遮蔽効果と呼びます。①原子核周りの電子密度が大きい場合 ② 環電流効果 が働くとき に特に遮蔽効果が強くなることが知られています。
水素核そのものはどれも全く同じ構成ですが、 置かれる環境次第で、原子核が感じる磁場の強さが異なる というわけです。結果として、前回述べた励起波長(=共鳴周波数)に標準からの”ズレ”が生じます。この”ズレ”こそが 化学シフト と呼ばれるものに相当します。つまり、化学シフトを測定することで、原子核の置かれている環境情報が得られるのです。
通常の 1 H-NMR測定における化学シフト値は、 テトラメチルシラン(TMS)のメチル基を基準(δ = 0)とした相対値 として、ppmスケールで記録されます。過去の測定事例から、どのような部分構造がどのような化学シフト値を示すのかについても、だいたいの目安が知られています(下図)。

こちらのページ より引用
2.カップリングとスピン結合定数(J)
化学的に非等価な核種同士が近傍に存在する時、両者は互いに影響しあって、エネルギー準位の分裂を生じます。これが カップリング と呼ばれる現象です。
1 H-NMRチャート上では、プロトンH a の隣にn個の等価プロトンH b が存在すると、H a のピーク山が(n+1)本に分裂して観測されます。それぞれのピークは、山の本数によって以下の記号で表記されます。
- 一重線:シングレット(singlet, s)
- 二重線:ダブレット(doublet, d)
- 三重線:トリプレット(triplet, t)
- 四重線:カルテット(quartet, q)
- 幅広線:ブロード (broad, br)
たとえば下記化合物においては、H b の隣には化学的等価なH a が2つ存在します。このためH b のピークは2+1=3本に分かれたトリプレット(t)となります。逆にH a から見ると隣のH b は1つなので、H a のピークは1+1=2本に分かれたダブレット(d)となります。

こちらのページ より引用
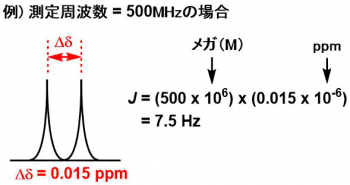
またカップリングしたピーク山同士の間隔は、 スピン結合定数( J 値) として記述されます。カップリングしている各種同士は、まったく同じ値の J 値を共有しますので、 J 値は どの核種同士が近接しているかを知る指標 になります。 J 値は以下の式で計算されます。
J (Hz) = 測定周波数 (Hz)x 化学シフト差分(Δδ, ppm)
例えば500MHzの装置で 1 H-NMRを測定し、化学シフト差分Δδ= 0.015 ppmと計算されるケースでは、 J 値は(500 x 10 6 ) x (0.015 x 10 -6 )= 7.5 Hzと計算できます。
このカップリング原則は、異核種同士にも当てはまります。つまりは、 13 Cでも 1 Hとちゃんとカップリングします。とはいえNMR測定経験のある方なら、 13 C-NMR測定で得られるチャートがシンプルそのものであることをご存じでしょう。これは 1 Hとのカップリングを抑えるパルス系列(デカップリング法)を使って測定している ことが理由です。 13 C- 1 Hカップリングが大した情報にならないことに加え、少しでも感度を稼ぐ意味合いもあります。また 13 C同士が隣接する可能性はほとんどないため、 13 C- 13 Cカップリングの影響はほぼ無視できます。
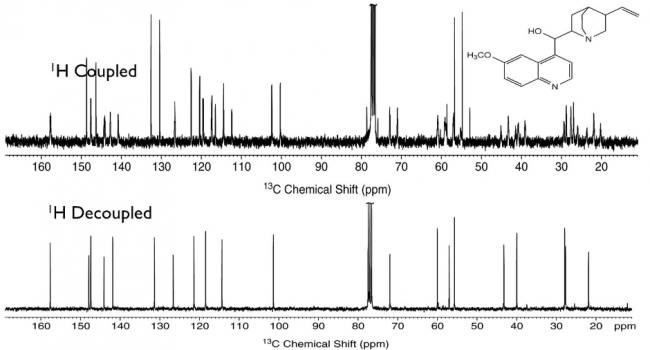
13 C-NMRにおける 1 H-デカップリングの効果 ( こちらのスライド より引用)
3. ピーク面積
フーリエ変換後に得られる各ピークの面積値は、核種の存在比に対応しています。
1 H-NMRの場合は定量性が高いため、積分比を求めることで、同一環境にあるプロトンの存在比を求めることができます。
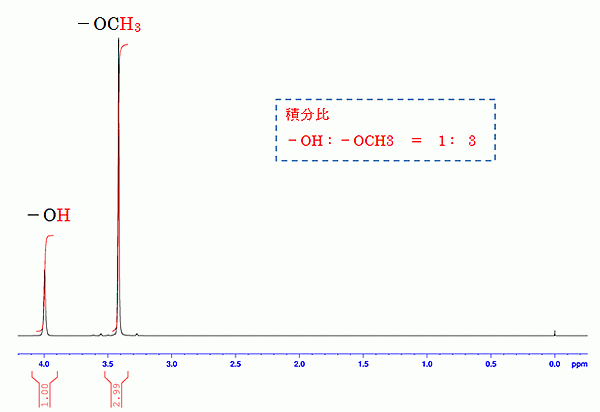
メタノールCH 3 OHのNMRチャート。3つのCHと1つのOHに対応するピーク面積(積分値)が3:1の比で計算されている ( こちらのページ より引用)
あくまで相対比ですので、等価プロトン多めな対称性の高い構造の場合は要注意です。また、 酸性度の高いプロトンは重溶媒との重水素交換を起こすことが多く、定量性が損なわれるケースが多い ことも留意しておく必要があります。
13 C-NMRにおいては、 13 Cピーク強度から炭素数を見積もることは、通常の測定法では行ないません。定量性がないことがほとんどだからです。
試料の調製法
試料化合物( 1 H-NMR測定の場合は数mg)を、NMR測定用溶媒(約0.4 mL)に溶かします。これをNMRチューブ(外径 約5mm)に入れ、キャップをすればOKです。試料が完全に溶解しており、クリアな溶液になっていることが必須です。不溶物が多く懸濁液になっていると、良質なデータが得られません。
こちらのページ より引用
1 H-NMRを測定するには、溶媒の水素(H)を重水素(D)に置き換えた 重溶媒 を使います。多くのプロトンが含まれる普通の溶媒(軽溶媒)を使ってしまうと、試料化合物の 1 Hピークがチャート上で埋もれてしまうためです。また現代のNMR測定では、重水素指定で ロック をかけるため、重溶媒の使用が必須となっています。
とりわけルーチン測定用には、重クロロホルム(CDCl 3 )が用いられます。これは以下の様な理由からです。
- 重水素が一つしか含まれないので、安価に製造できる
- 沸点が適度に低いので、測定後に溶媒を留去してサンプルを回収出来る
- 大抵の有機化合物を溶解し、また反応性も低い
- 不純物として含まれる軽溶媒CHCl 3 が試料ピークと被りにくく、かつシングレットピークなので、区別しやすい

重クロロホルム溶媒
解析の実例
それでは実際に、簡単な分子の 1 H-NMRスペクトル解析例を見てみましょう。チャートから得られる情報は、ざっくりと以下の対応があると覚えておけば良いでしょう。
ピーク面積 → 水素原子の数
ピーク山の数 → 隣にある水素原子の数
化学シフト値 → 水素原子の電子的環境(左にあるほど電子不足)
ピーク山同士の間隔 → どの水素原子同士が隣り合っているか
酢酸
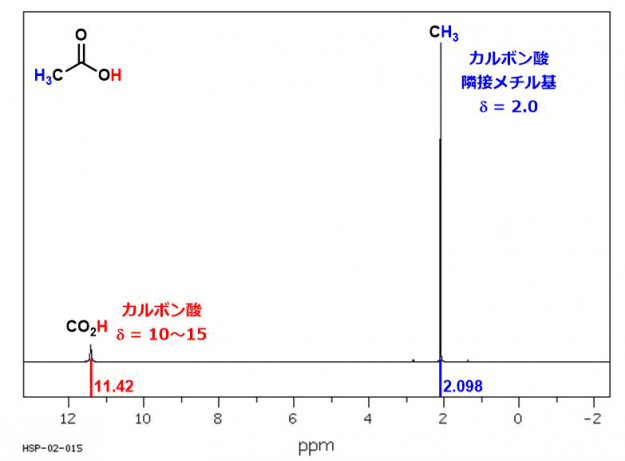
解析は非常に簡単である。酢酸にはメチル基のプロトンとカルボキシル基のプロトンの2種類しかない。お互い隣接せずカップリングしないので、それぞれがシングレットピークになる。カルボン酸プロトンの化学シフト値は非常に特徴的な範囲(10~15 ppm)に現れる。
アクリル酸
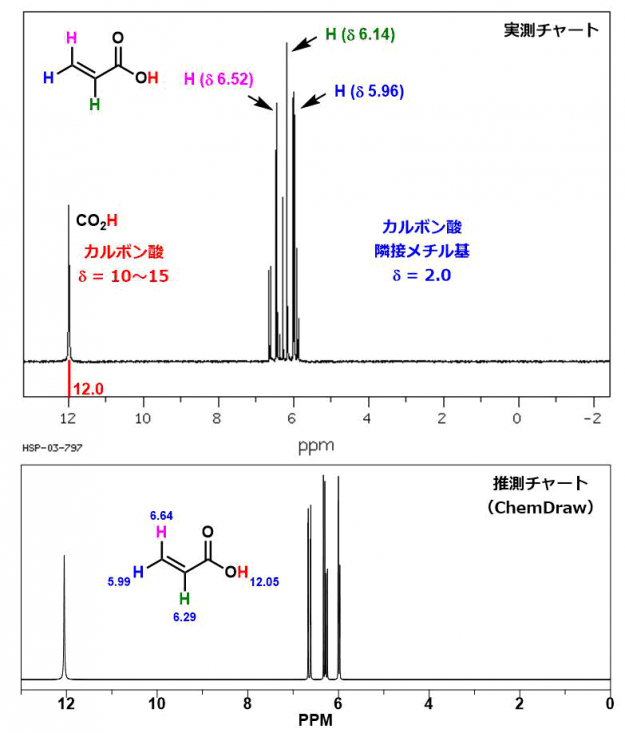
アクリル酸にはオレフィンに直結した互いに非等価なプロトン3つと、カルボン酸プロトン1つが含まれる。カルボン酸プロトンの化学シフト値は特徴的なゾーン(10~15 ppm)に現れる。オレフィンに直結したプロトンは、推測値( ChemDraw などのソフトで簡便に見積もれる)と実測値を比較することでアサインできる。6 ppm付近に現れている小さいピークは、オレフィンのプロトン同士のカップリングに由来する。
【原理編】は こちら



