本特集では、核酸医薬品やオリゴヌクレオチド合成に関連する事業や研究に役立つ情報をご案内しております。ホスホロアミダイト法や分離精製等の各工程に関して分かりやすく解説していますので、ぜひご覧ください。
また関東化学では、キャッピング剤など、核酸合成に必要な各種試薬を開発し、製品化しています。 他にも幅広い用途でお使いいただける脱水溶媒や、各種カラム、アプリケーションを取り揃えていますので、こちらについても併せてご覧ください。
2. ホスホロアミダイト法
2-1. 脱保護(脱トリチル化)
2-2. カップリング
2-3. キャッピング
2-4. 安定化(酸化/硫化)
2-5. 後処理工程
3. オリゴヌクレオチドの精製・分析
4. 関連製品動画
5. お問い合わせ・お見積り依頼
1. 核酸について
核酸とは
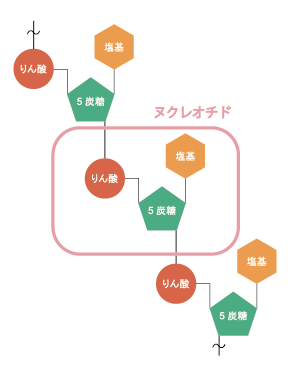
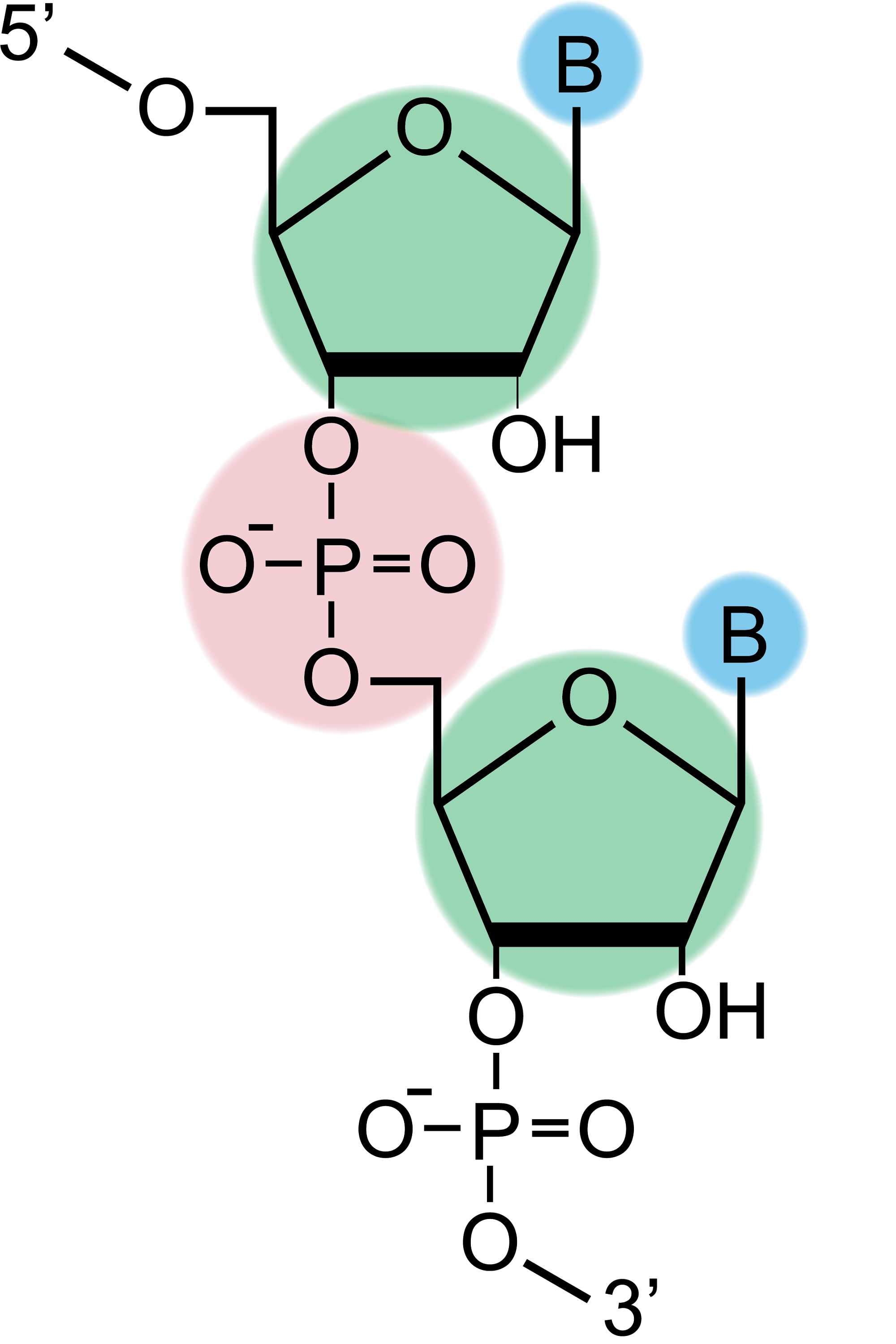
核酸とは、デオキシリボ核酸(DNA)とリボ核酸(RNA) の総称で、塩基、5炭糖、リン酸からなるヌクレオチドが、鎖状に連結し構成されている有機化合物です。これらは、DNAが遺伝情報を記憶し、RNAがその情報に応じたタンパク質を合成するなど、生物が細胞を作り出すうえで大きな役割を担っています。
近年、核酸に対する注目が高まりつつあります。その理由の一つとして、医薬分野における核酸の創薬モダリティとしての実用可能性が挙げられます。
核酸医薬品
核酸医薬品とは、天然型ヌクレオチドあるいは化学修飾型ヌクレオチドで構成されており、化学合成によって製造される医薬品のことをさします。これらは一般に、塩基が十数個から数十個程度連結した比較的短いヌクレオチドの重合体(オリゴヌクレオチド)で、タンパク質に翻訳されることなく直接生体に作用します。この点が、生体内でタンパク質を発現させる遺伝子医薬品とは異なっています。
核酸医薬品の特長と課題
低分子医薬品は市場規模が大きく、依然として製薬市場の中心的な創薬モダリティです。一方で、核酸医薬品や抗体医薬品等の中~高分子医薬品市場も成長を見せています。
中でも核酸医薬品は、低分子医薬品や抗体医薬品とは異なり、RNAをターゲットとすることが可能です。その特異性の高さから、今まで治療することが難しかった遺伝性疾患等に対する、新たな創薬モダリティとして注目されております。加えて、低分子医薬品のように化学合成が可能であることや、抗体医薬品などと同等の有効性を持つことなど、中間的な特長を持っています。
一方で課題もあり、生体内での易分解性、オフターゲット効果、肝・腎毒性、修飾核酸技術や薬物送達技術(DDS)が開発途上段階であることが挙げられます。
主な核酸医薬品の種類
核酸医薬品には多くの種類があり、それぞれ構造やターゲットが異なっています。
| 核酸医薬品 | 構造 | 標的 | 作用部位 | 作用機序 |
|---|---|---|---|---|
| アンチセンス | 一本鎖DNA またはRNA |
mRNA miRNA等 |
細胞質内 核内 |
mRNA分解 スプライシング阻害 |
| siRNA | 二本鎖完全 相補鎖 |
mRNA | 細胞質内 | mRNA分解 (RNAi干渉) |
| miRNA | 二本鎖完全 相補鎖または非完全相補鎖 |
mRNA | 細胞質内 | 翻訳阻害 mRNA分解 |
| アプタマー | 一本鎖DNA またはRNA |
蛋白質 | 細胞外 細胞表面 |
機能阻害 |
| CpGオリゴ | 一本鎖DNA | 蛋白質 | 細胞表層 | 免疫賦活 |
| デコイ | 二本鎖DNA | 転写因子 | 細胞質内 核内 |
転写阻害 |
これらの核酸医薬品は、日本でも6種の商品が承認されております(2023年8月時点)。 日本において、2023年8月時点で認可されている核酸医薬品はこちらから確認いただけます。
出典:国立医薬品食品衛生研究所 遺伝子医薬部ホームページより一部抜粋
核酸合成
核酸は有機化合物であり、人工的に合成することが可能です。その中のオリゴヌクレオチドの合成には液相法と固相法があります。
液相法は、スケールアップが容易なため、大量合成が可能という特徴があります。一方で、一般的に合成手法の確立や反応溶媒から目的のオリゴヌクレオチドを分離することが難しく、可溶化担体などの合成技術、ノウハウが必要となり、アカデミアや化学メーカーが独自技術の開発を行っています。
固相法は、合成手法が確立されていることや固相担体上で反応を進めるため簡便に洗浄ができることから、比較的容易に合成を行うことができます。 しかし、反応や洗浄の際に過剰量の試薬を使用するため合成コストが高いことや環境負荷が大きいことが課題となっております。この固相法では、主にホスホロアミダイト法が用いられています。
| 合成法 | 合成難易度 | 合成スケール | 試薬使用量 |
|---|---|---|---|
| 固相法 | 比較的容易 | 少量多品種向き | 多い |
| 液相法 | 技術やノウハウが必要 | 大量生産向き | 中程度 |
2. ホスホロアミダイト法
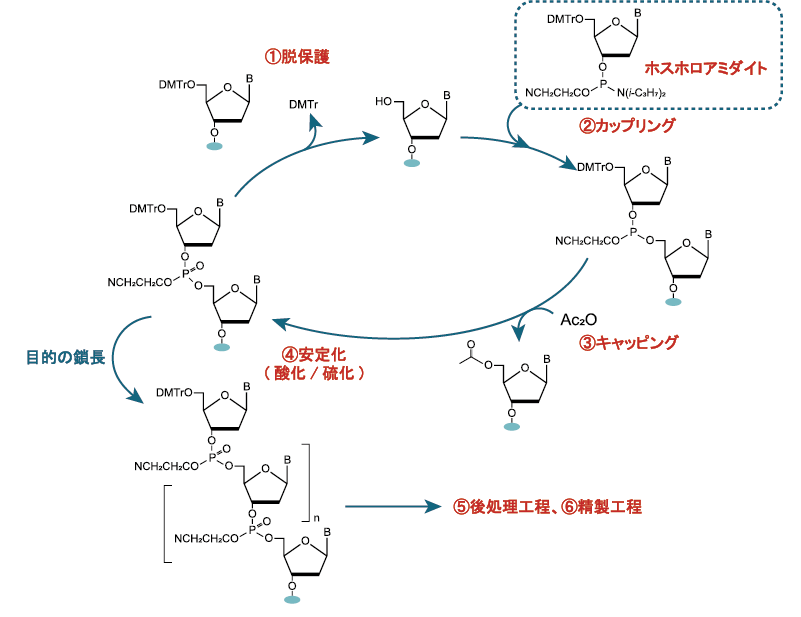
ホスホロアミダイト法は1980年代にCaruthers博士らによって開発され、現在最も主流なオリゴヌクレオチド合成法として用いられています。ガラスビーズ、樹脂ビーズなどの固相担体表面のアミノ基にリンカーを介してヌクレオシドを連結させます。連結させたヌクレオシドへ上記①~④ の工程を繰り返すことで、目的の鎖長のオリゴヌクレオチドを合成します。
この合成法は工程数が多く、最終的な収率が低くなる傾向があります。より効率的にオリゴヌクレオチドを合成するためには、各工程での収率を100%に近づけなければなりません。また、溶媒中に含まれる水分によって収率が低下することがあるため、脱水溶媒を使用することでその影響を抑えることができます。
2-1. 脱保護(脱トリチル化)
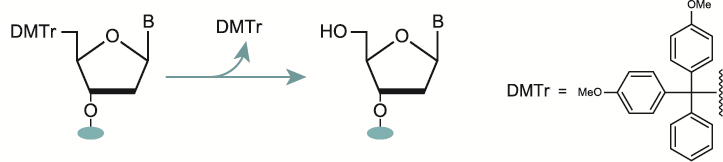
ヌクレオシドの3’位を選択的に固相に担持させるために5'位の水酸基はDMTr基で保護されています。カップリングを行う際に5’位が反応点となるため、デブロック剤を使用してDMTrの脱保護を行います。 この際、デブロック剤に弱い酸の使用や酸との接触時間を短くすることで脱プリン(酸によりプリン塩基が脱離すること)を抑える可能性が高くなります。
長鎖のオリゴヌクレオチドの反応に対してはトリクロロ酢酸より比較的反応が穏やかなジクロロ酢酸が適しており、接触時間の短縮には反応に要する時間が短いトリクロロ酢酸が適しています。
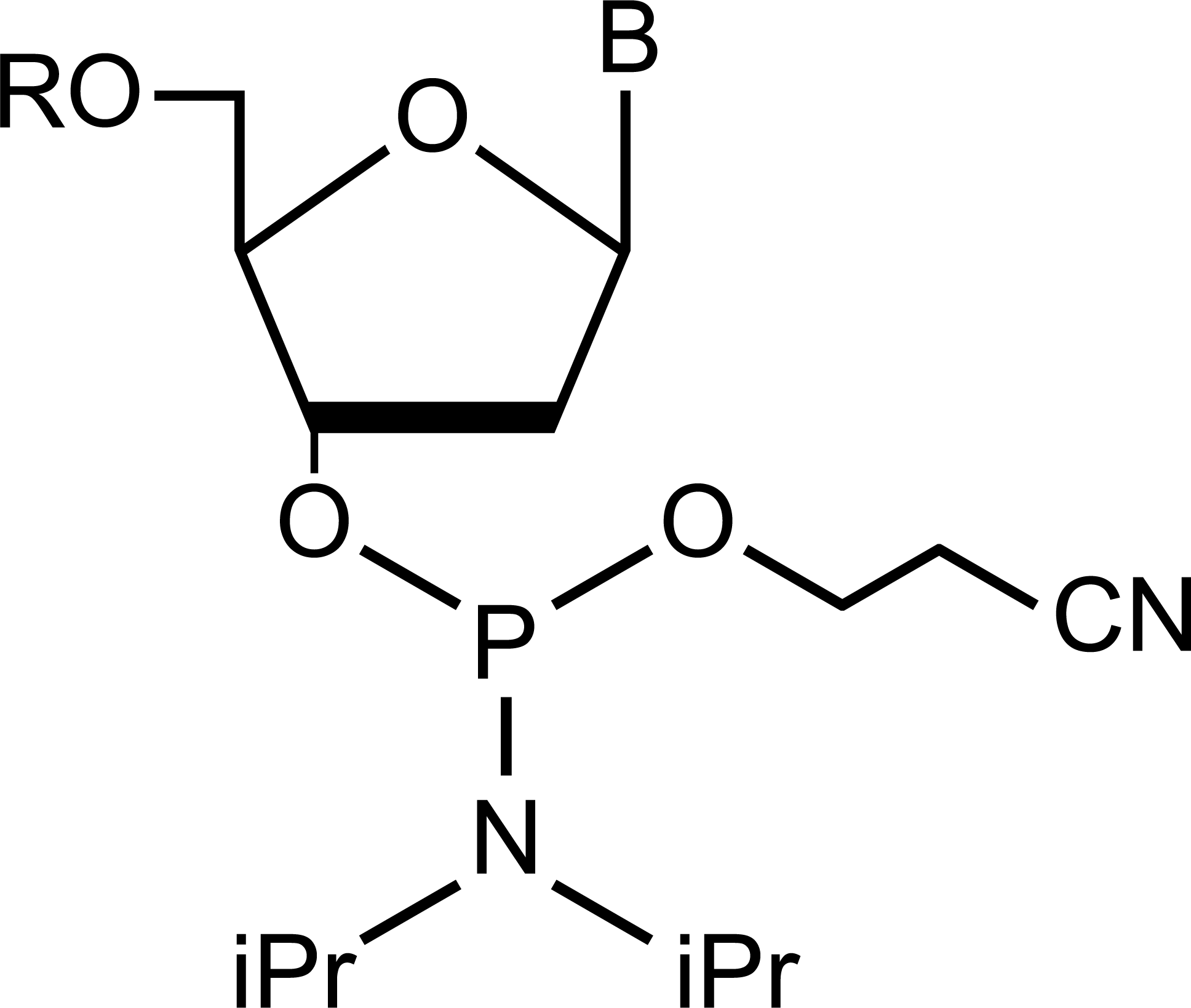
2-2. カップリング
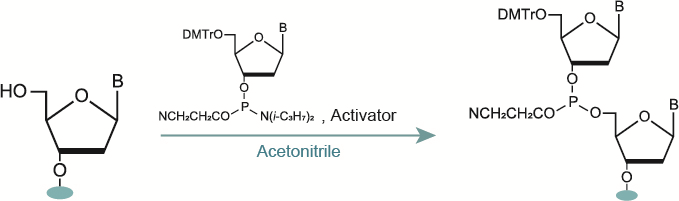
脱保護で5’-水酸基となったポリヌクレオチドにホスホロアミダイトモノマーを結合させます。 この際、カップリングにはアクチベーター試薬を使用します。アクチベーター試薬には吸湿性のない5-エチルチオ-1H-テトラゾールや5-ベンジルチオ-1H-テトラゾールなどを用います。
また、水を嫌う反応であることから、溶媒として低水分のアセトニトリルを使用することや、ホスホロアミダイトモノマーとアクチベーター試薬を過剰量使用することでカップリング効率を高めることができます。
2-3. キャッピング
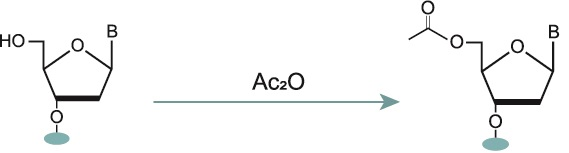
カップリングの際に縮合反応が進まなかった5’-水酸基のオリゴヌクレオチドは、未反応物として残り、次回以降のサイクルで分離が困難な不純物となることがあります。 この未反応物ができる割合は一般的に1サイクル当たり2%程度ですが、繰り返し行うことで未反応物の割合はさらに大きくなり収率低下につながります。
収率低下を抑えるためには、カップリング後に無水酢酸とN-メチルイミダゾールの反応物を用いてキャッピングを行うことにより、未反応物をアセチル化し不活性化させる必要があります。
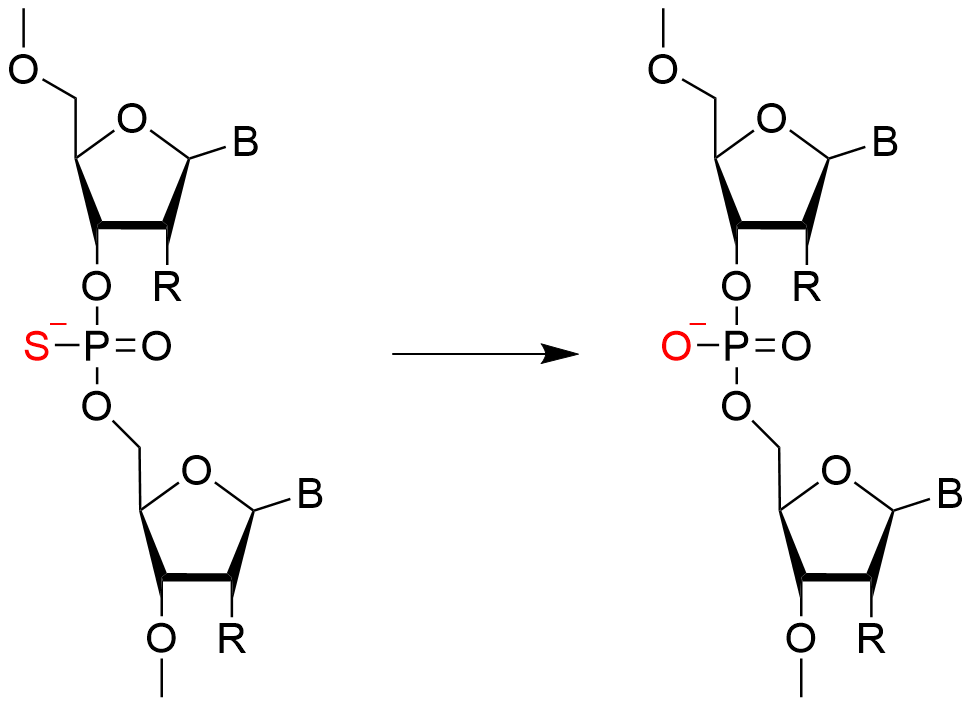
2-4. 安定化(酸化/硫化)
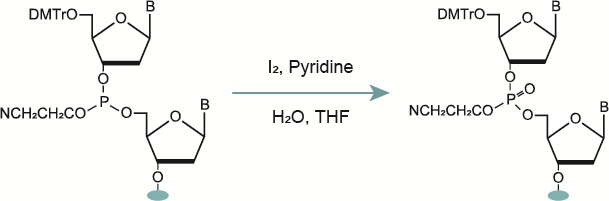
カップリング反応で形成された亜リン酸エステル結合は安定性に欠けており、酸によって加水分解されることがあるため、安定化を行います。安定化の際には酸化剤を用いて亜リン酸エステル結合をリン酸エステル結合に変換する手法がとられています。 しかし、リン酸エステル結合は体内に含まれる酵素であるヌクレアーゼによって分解されるため、硫化させてチオリン酸エステル結合へと変換する方法もあります。
硫化反応はDDTTで数分程度処理する簡便な作業であり、広く知られていますが、硫化時の反応系中に水分子が含まれる場合、水分子によりPS→PO脱硫体の生成が見られます。そのため、硫化反応はキャッピング前に行う必要があります(1)。
ここまでのサイクルを目的の鎖長になるまで繰り返し、目的の鎖長になったら2-5の後処理工程を行います。
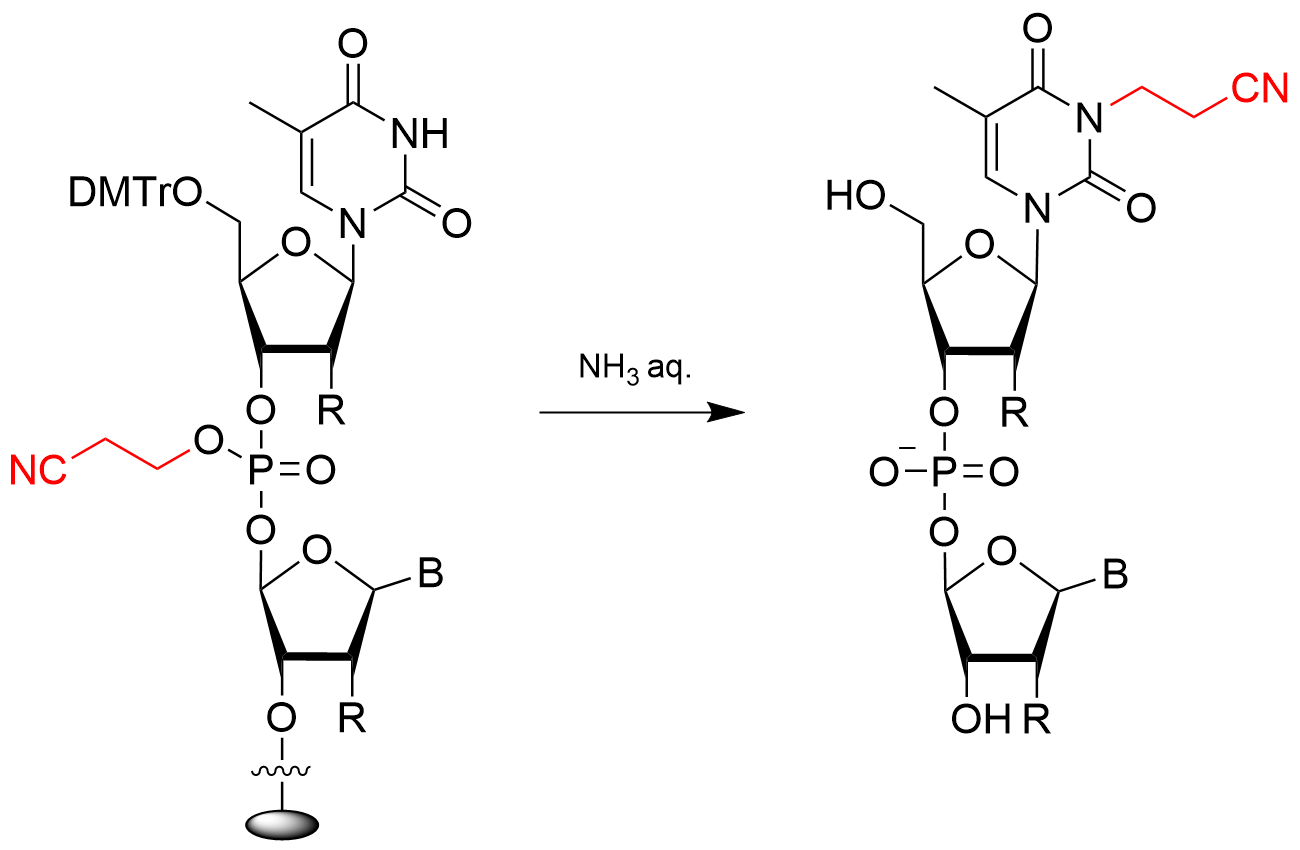
2-5. 後処理工程
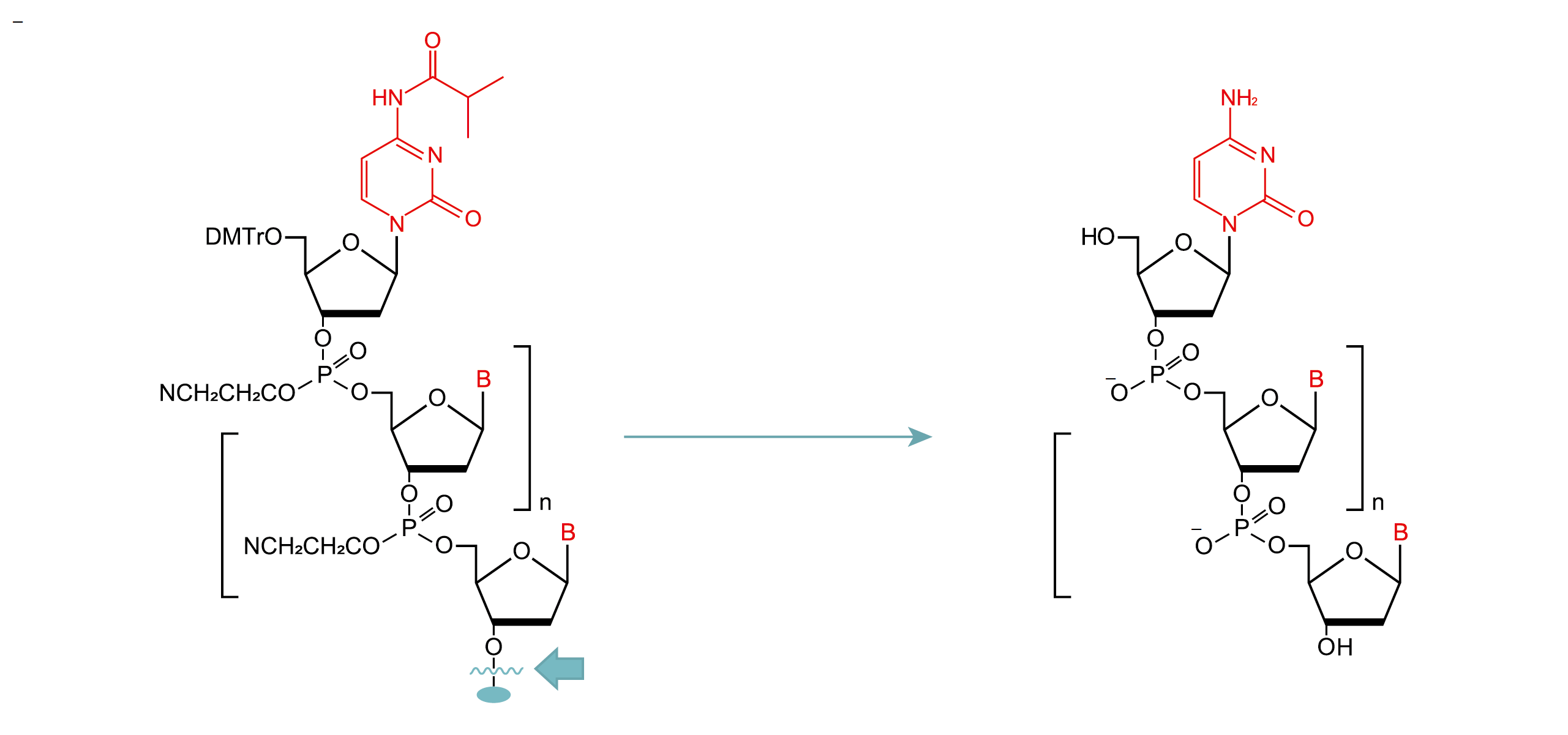
上記の合成サイクルで合成したオリゴヌクレオチドは固相に担持しているため、アンモニア水やジエチルアミンなどの塩基試薬を用いて切り出しを行う必要があります。 この際、同時に5’-保護基であるDMTr、核酸塩基(アデニン、グアニン、シトシン)の保護基、リン酸部のシアノエチル基の脱保護も行われます。
3. オリゴヌクレオチドの精製・分析
一般的にオリゴヌクレオチドは、固相担体上で伸長反応を繰り返した後、担体から切り出され、カラムクロマトグラフィー精製、限外ろ過濃縮、凍結乾燥の各プロセスを経て目的の核酸を得ます。
最後に、液体クロマトグラフィーによる品質確認を行います。
|
核酸
合成 |
 |
精製
|
 |
濃縮
脱塩 |
 |
凍結
乾燥 |
 |
分析
|
精製・分析
精製・分析は、一般的にイオンペア逆相クロマトグラフィー、陰イオン交換クロマトグラフィーを用いて行われています。長鎖の核酸に対してはポリアクリルアミドゲルを用いた電気泳動も活用されています。
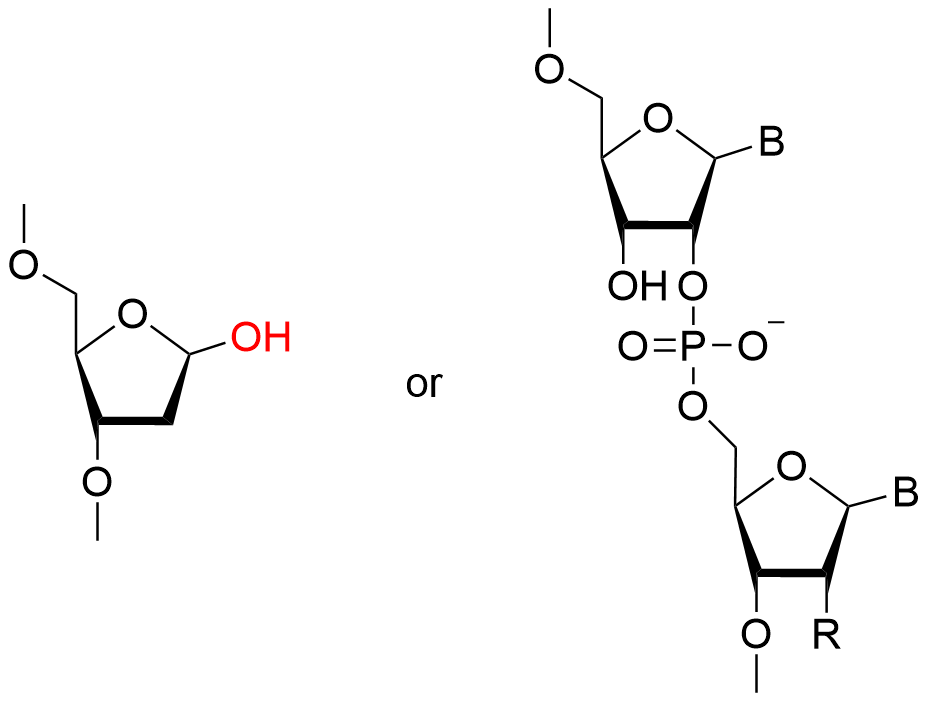
また、オリゴヌクレオチド合成は各工程で多くの不純物が生じます。それらは製造工程由来不純物や目的物質由来不純物と低分子~高分子化合物まで様々であるため、精製や分析の最適化が必要です。
・ホスホロアミダイトモノマー
・保護基由来の不純物等
・リン酸基、糖部、核酸塩基に関連する不純物
・目的生成物(N量体)に対してN-1欠損体、N+1付加体
PS→PO脱硫体等
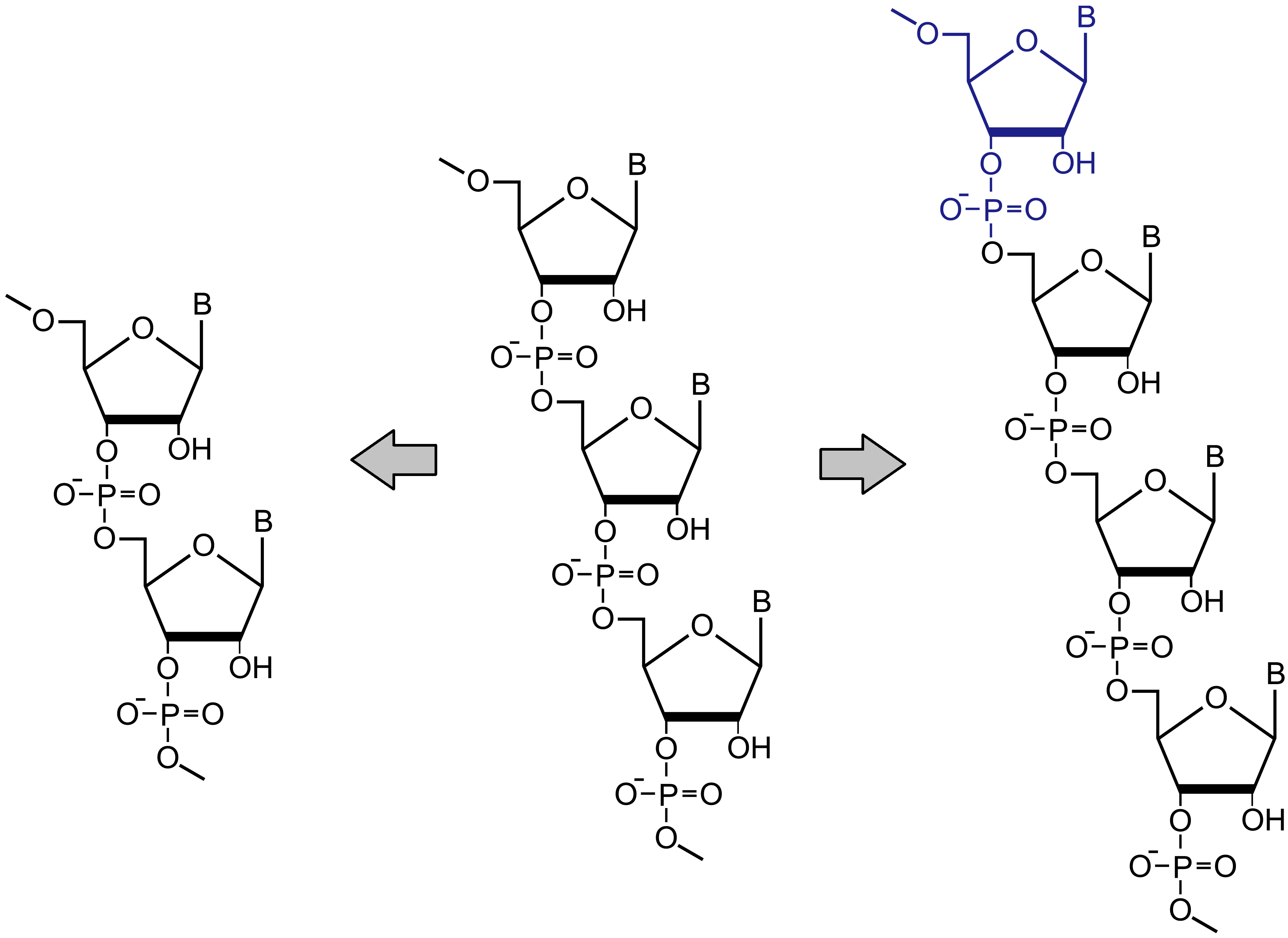
いずれも目的生成物と構造や物理化学的性質が類似しているため、精製・分析が難しいとされています。
取り扱い製商品
弊社では、精製・分析にご使用いただける下記の製商品を取り扱っております。
逆相カラム L-column3
核酸医薬品の代表的な不純物として、ヌクレオチド欠損体及び脱硫体(PS→PO)が挙げられます。 特にホスホロチオアート化(PS)オリゴヌクレオチドはリン原子が不斉中心となるためピーク形状がブロードとなり、不純物の分離が非常に困難となります。
この度、化学物質評価研究機構(CERI)では独自の分析メソッドを開発致しました。
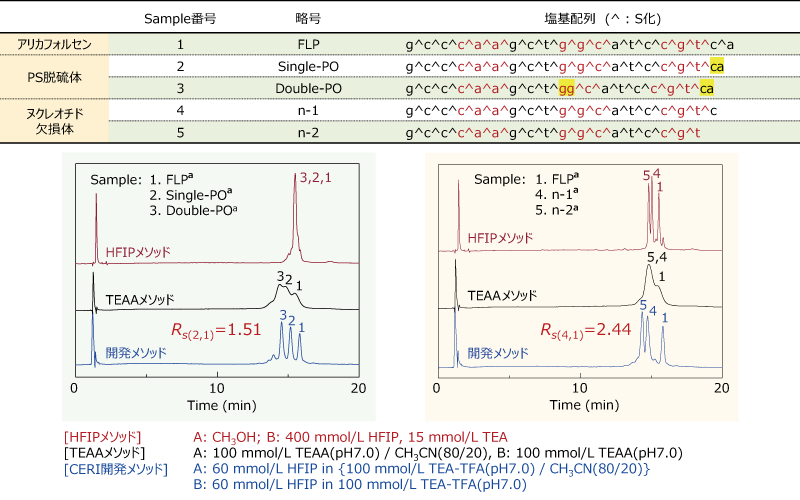
イオンペア逆相クロマトグラフィー
核酸はリン酸基(アニオン性)を有していることから逆相系の充填剤には保持されにくいため、 カチオン性のイオンペア試薬と酸が添加されています。弊社ではイオンペア逆相クロマトグラフィーでご使用いただけるイオンペア試薬とLC溶媒を各種取り揃えています。
| 検出器 | 溶離液の一般的な組み合わせ |
|---|---|
| UV検出 | TEAA/アセトニトリル |
| MS検出 | TEA-HFIP/メタノール or 水 |
2 mol/L TEAA溶液, pH7.0
トリエチルアミン酢酸塩(TEAA)は、イオンペア試薬の中でも特に広く用いられています。 弊社では調製品も取り扱っておりますので調製の煩雑さを省くことが出来ます。
| 項目 | 規格値 |
|---|---|
| 性状 | 試験適合 |
| pH(25℃) | 6.9-7.1 |
| 吸光度(260 nm) | 0.002以下 |
陰イオン交換クロマトグラフィー
オリゴヌクレオチドの負電荷を利用した静電気相互作用により、有機溶剤を使用しない水系移動相での分離が可能です。 弊社では、陰イオン交換クロマトグラフィー用試薬やAgilent社製品の陰イオン交換カラム等各種製品を取り揃えています。
電気泳動
アクリルアミドのモノマーには神経毒性がありますが、微粉末なので秤量の際に雰囲気中に舞い、吸入暴露や設備汚染の危険性があります。弊社では、調製済みの30(w/v)%アクリルアミド/ビス溶液をご用意しております。
濃縮・脱塩
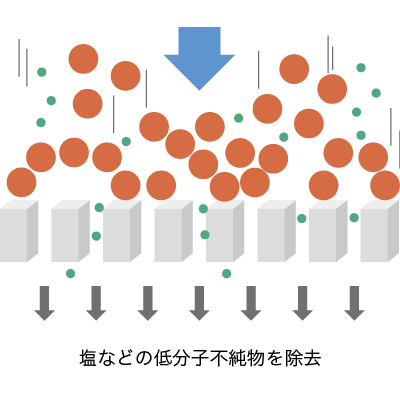
グローバルライフサイエンステクノロジーズジャパン社 製品
グローバルライフサイエンステクノロジージャパン社では、核酸関連製品としてイオン交換メンブレン製品、限外ろ過製品を取り扱っております。 適切なMWCO(分画分子量)を選定いただけるように最小1K~100Kまで幅広い商品ラインナップを対応しています。


4. 関連製品動画
ソルベントサプライシステムは、弊社の脱水溶媒SUS容器から簡単・安全にハンドリングできる脱水溶媒供給システムです。
気密性を保持した状態で有機溶媒を簡単に取り出すことができ、取り出した後は操作パネルの配管部分に残留した溶媒を不活性ガスでパージできます。逆止弁を使用しているので安全性も向上しています。
以下の動画より、製品の特長と使用方法をご覧いただけます。
5. お問い合わせ・お見積もり依頼
本件についてのお問い合わせおよびお見積り依頼はこちらよりお願いいたします。
お見積りは最寄りの弊社支店・営業所もしくは販売店よりご回答いたします。