経上皮電気抵抗(TEER)測定装置

ad-MEDビトリゲル®2(12ウェル用、24ウェル用)専用の経上皮電気抵抗(TEER)測定用装置です。各種上皮細胞や内皮細胞におけるバリア機能の評価にお使いいただけます。
経上皮電気抵抗(TEER)とは
経上皮電気抵抗(Trans-Epithelial Electrical Resistance: TEERまたは、TER)とは、一定の電流を細胞層に印加した際に生じた電圧を測定し、得られた値から換算された抵抗値のことです。上皮細胞(Epithelial cells)には、生体の内と外を隔てるバリア機能が存在します。TEER値は、培養された細胞層のバリア機能を非侵襲的かつリアルタイムに評価する指標として使用されています。TEER値を測定する主な対象として、角膜・鼻腔・口腔粘膜・気道・皮膚・腸管・胎盤・腎・膀胱上皮細胞モデル、血管内皮細胞モデル、血液脳関門モデルなどが挙げられます。TEER値の測定は、作製した細胞モデルの健全性確認や、被験物質の毒性評価などの用途で広く利用されています。
特長
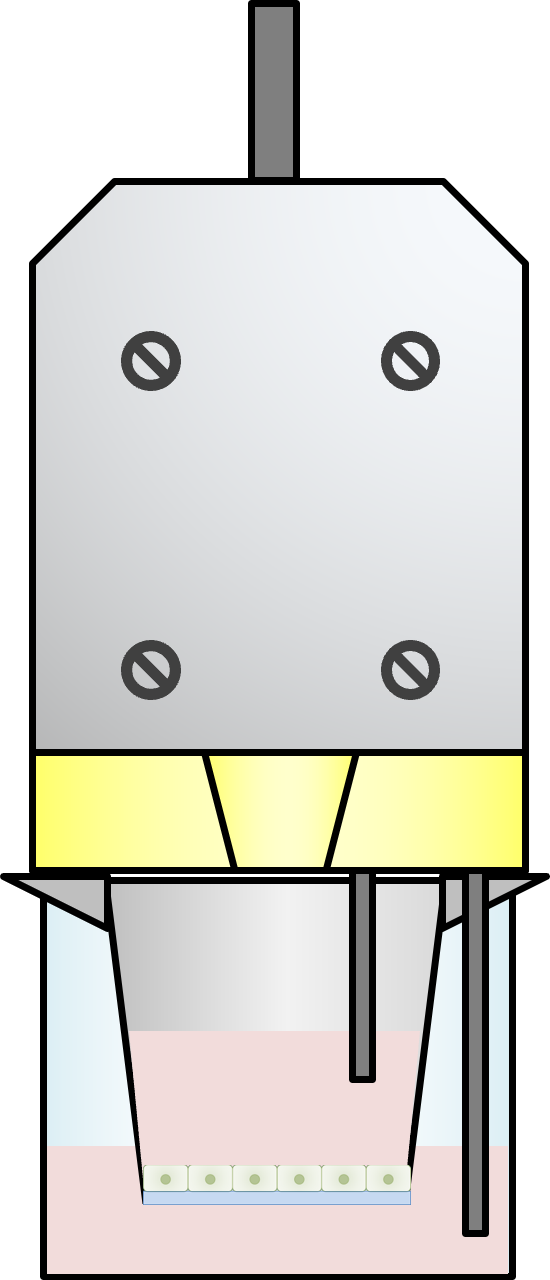
- 据え置き型電極によって安定した測定が可能
ad-MED ビトリゲル®2(12ウェル用、24ウェル用)と組み合わせることで、測定値の変動を抑え、安定した測定を可能にします。また、電極のプローブ部分は、耐食性の強い素材を採用しています。 - TEER値を測定しながら被験物質を添加可能
据え置き型電極のスリット構造を通して、インサート内に被験物質を添加することが可能です。被験物質の暴露による影響をリアルタイムに捉えます。また、市販の温度センサーを取り付けることで、培地温度のモニタリングも可能です。
- 専用ソフトでの経時測定・データ保存機能
装置付属の専用ソフトをお手持ちのPC上で起動し、任意の測定インターバルを設定することで、経時的なTEER値測定を可能にします。また、測定したデータは、CSVファイルに出力することが可能です。
TEER値の測定方法
セルカルチャーインサート(ad-MED ビトリゲル®2)の内・外に専用電極のプローブ部分をセットし、培地とインサートを通すように微弱な電流を印加することで、インサート上の細胞層の電気抵抗(TEER)値を求めます。細胞を培養したインサートと、細胞を培養せずに培地のみを入れたインサート(blank)を用意します。それぞれ電極をセットし、装置本体に表示された値を差分を算出します(全抵抗値 - ブランク抵抗値)。表示値の単位は、Ωです。これに有効膜面積を乗じた単位膜面積抵抗値(Ω・cm2)がTEER値のデータとなります。
※ad-MED ビトリゲル®2の有効膜面積は、12ウェル用で1.0cm2, 24ウェル用で0.33cm2です。
論文使用実績
線維柱帯細胞モデル
- Establishment of appropriate glaucoma models using dexamethasone or TGFβ2 treated three-dimension (3D) cultured human trabecular meshwork (HTM) cells
M.Watanabe, Y.Ida, H.Ohguro, C.Ota, F.Hikage
Scientific reports 11.1 (2021): 19369.
血管内皮細胞モデル
- Novel microvascular endothelial model utilizing a collagen vitrigel membrane and its advantages for predicting histamine-induced microvascular hyperpermeability
M.Uzu, T.Takezawa
Journal of Pharmacological and Toxicological Methods, 106 (2020). - A hybrid human microvascular endothelial cell line created by utilizing a cell fusion technique and its advantage for expressing high endothelial barrier function
M.Uzu, T.Takezawa
Nano Biomedicine, 14 (1), 9-17 (2022). - Vascular endothelial dysfunction induced by 3-bromofluoranthene via MAPK-mediated-NFκB pro-inflammatory pathway and intracellular ROS generation
Lee CY, Wu SW, Yang JJ, Chen WY, Chen CJ, Chen HH, Lee YC, Su CH, Kuan YH.
Arch Toxicol. 2024 Apr 18. doi: 10.1007/s00204-024-03751-0.
皮膚・表皮角化細胞モデル
- Rosae Multiflorae Fructus Extracts Regulate the Differentiation and Vascular Endothelial Cell-mediated Proliferation of Keratinocytes
S.Asayama, T.Igarashi, Y.Abe, A.Iwasaki, M.Kubo, A.Ikeda, K.Akiyama, T.Okamoto, M.Yagi, Y.Niki, H.Ando, M.Ichihashi, K.Mizutani
Bioscience, Biotechnology, and Biochemistry, zbaf007 (2025).
腎臓近位尿細管上皮細胞モデル
- COMMD5 counteracts cisplatin-induced nephrotoxicity by maintaining tubular epithelial integrity and autophagy flux
M.Ogasawara-Nosoko, H.Matsuda, J.Ikeda, M.Abe, Y.Masuhiro, M.Endo, P.Hamet, J.Tremblay
American Journal of Physiology-Renal Physiology, 327.5 (2024).
気管支上皮細胞モデル
- The Modulation of Respiratory Epithelial Cell Differentiation by the Thickness of an Electrospun Poly-ε-Carprolactone Mesh Mimicking the Basement Membrane
Choi, S. Y., Kim, H. J., Hwang, S., Park, J., Park, J., Lee, J. W., Son, K. H.
International Journal of Molecular Sciences, 25(12), 6650 (2024).
口腔粘膜上皮細胞モデル
- Porphyromonas gingivalis がヒト口腔粘膜上皮細胞に与える影響の 3 次元構築モデルによる解析
笠孝成, 内田邦敏, 岡村和彦, 八田光世, 山﨑純, 坂上竜資
日本歯科保存学雑誌, 63(2), 144-155 (2020).
製品一覧
・「法律」,「SDS」,「在庫」など詳細情報は、[Cica-Webで確認]ボタンをクリックいただきご確認いただけます。
・試薬のご購入とご使用に際して
パンフレット
関連製品ページ
ライフサイエンスに関する
お問い合わせ
メールでのお問い合わせ
お電話でのお問い合わせ


