
この度、関東化学株式会社は、東京工業大学 生命理工学院 生命理工学系の粂昭苑教授らとの共同研究の成果として、ヒトiPS細胞由来小腸前駆細胞から成熟化したヒト腸管上皮細胞を高効率に作製するための培地「ciKIC® IEC Maturation Medium」を発売いたしました。本培地を用いることで、薬剤の吸収、代謝の解析に有用なヒトiPS細胞由来腸管上皮モデルを作製することができます。
目次医薬品開発における課題
医薬品の開発フェーズでは、候補化合物の薬効や安全性を確認する種々の試験があり、副作用等の問題がみられた場合、開発中止に追い込まれてしまいます。特に人での臨床試験段階でのドロップアウトとなると、それまでの莫大なコスト(研究費と時間)の損失は計り知れないものです。そのような事態を防ぐためには、生体内での挙動を開発の初期段階(非臨床試験段階)でいかに精度高く予測できるかが重要になります。
開発初期段階における従来の試験法
実験動物を用いた非臨床性能試験
人での臨床性能試験を行う前に、ラット、イヌ、サルなどの実験動物に医薬品候補化合物を投与して体内での挙動を調査する検討が一般的に行われます。動物実験のメリットは、薬物の体内動態を一個体として調査できる点が挙げられますが、デメリットとして、種差が大きい点が挙げられます(課題①)。例えば、CYP3A4の基質として知られるミダゾラムを投与した際、ヒトのバイオアベイラビリティー(BA)が約33%であるのに対し、ラットは1.1%、イヌは15.1%、サルは2.1%のBAを示すという報告があります1)。このように、実験動物を使用した非臨床性能試験では、一部の薬物において種差が大きいことが認められており、動物実験をクリアした候補化合物だとしても、臨床性能試験段階において人に投与した時に所期の薬効が認められなかったり、予期しない副作用が発生したりする恐れがあります。また、近年では、動物愛護の観点から実験動物の3Rの原則、すなわち置換(Replacement)、削減(Reduction)、苦痛軽減(Refinement)に対する意識が高まり、実験動物を使用しない方法に代替することが求められています。
組織モデルを用いた非臨床性能試験
培養プレート上で一定期間培養したヒト由来の細胞を用いた試験方法は、動物実験の削減に加え、種差の問題も解消できることから、動物実験の代替技術として期待されています。試験に用いるヒト細胞は、健常な人から提供された細胞を使用することが試験結果の普遍性や頑健性に有効ではありますが、同細胞を創薬研究用に安定的に入手することは倫理的に極めて困難です。そのため、入手が容易で品質が比較的安定な株化細胞が多くの試験法で使用されていますが、生体由来の細胞と比較すると、生物本来の機能が不足していることが多くの場合で認められます。このような課題に対して、ES/iPS細胞や間葉系幹細胞等から各種の試験に適合した細胞を分化誘導する研究が盛んに行われています。
腸管上皮モデルの必要性
医薬品の開発過程では非常に多くの試験を行う必要がありますが、ここでは、医薬品が体内に吸収される工程に限定して説明します。医薬品を目的の組織に届けるための投与方法には様々な方法がありますが、最も一般的な経口薬の場合、腸管に存在する腸管上皮細胞を介して血中に吸収されます。腸管上皮細胞は、種々のトランスポーターや薬物代謝酵素を発現しているため、薬物の体内動態に大きく関わってきます。そのため、特に腸管上皮細胞における吸収ならびに代謝の評価は、薬物の投与量に応じた有効性と安全性を予測するための重要な項目の一つです2)。
腸管上皮モデルの場合、ヒト結腸がん由来のCaco-2細胞が一般的に利用されています。Caco-2モデルのメリットは、入手や培養操作が容易で、ヒト腸管上皮の機能を部分的に再現している点です3)。しかし、デメリットとして、ヒト腸管上皮に発現している遺伝子を一部発現していないこと(課題②)、また主要な薬物代謝酵素(CYP3A4)の活性が不十分であること(課題③)から、薬物の吸収・代謝を精度高く評価することが難しいという課題があります。そのため、よりヒト生体の細胞に類似した腸管上皮モデルが強く望まれています。
開発培地で培養したヒトiPS細胞由来腸管上皮モデル
当社製品ciKIC® IEC Maturation Mediumを用いて作製したヒトiPS細胞由来腸管上皮モデルは、従来の動物実験および組織モデル(Caco-2モデル)の課題①~③を克服しています。
本モデルは、ヒトiPS細胞から分化誘導した腸管上皮細胞4), 5), 6)(特許5875007を使用した東京工業大学の技術)を使用して作製した組織モデル7)です(課題①の解決)。ヒトiPS細胞由来腸管上皮細胞として、㈱リプロセル販売の「StemRNA Entero」を細胞培養用インサートであるad-MED ビトリゲル®2(24 well)に播種し(Day0)、Day5から本培地(ciKIC® IEC MM)を使って培養を行うことでヒト腸管上皮モデルを作製できます(図1)。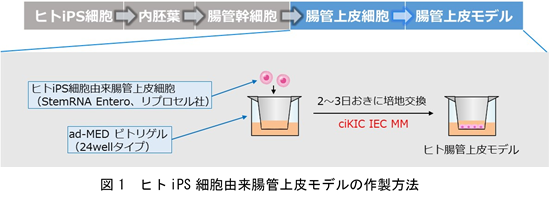
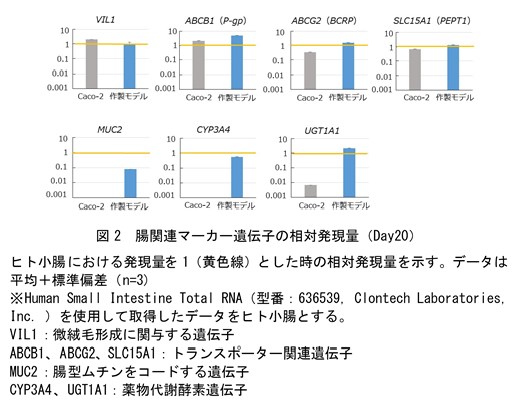
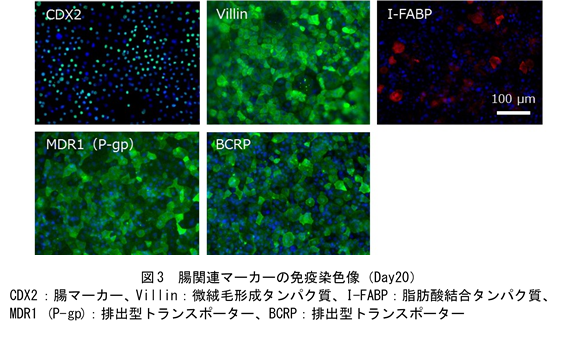
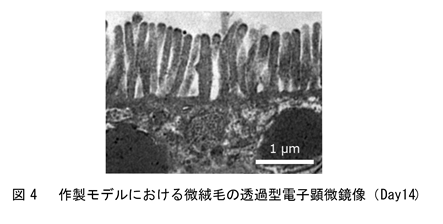
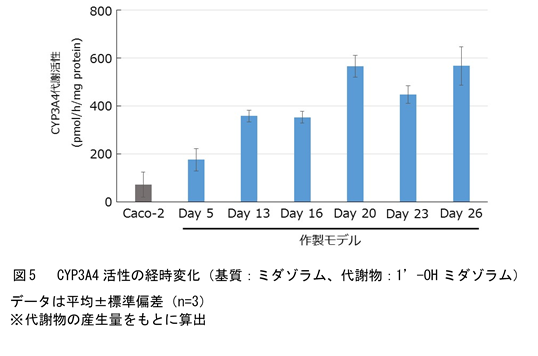
上記の方法で作製したヒトiPS細胞由来腸管上皮モデル(以下、作製モデル)は、薬剤の吸収・代謝・排出に関与する主要なトランスポーターおよび代謝酵素の遺伝子を発現しているだけでなく、Caco-2モデルでは発現がほとんど認められない腸関連マーカー遺伝子(MUC2, CYP3A4, UGT1A1)を発現しています(課題②の解決、図2)。蛍光免疫染色により生体内の腸管上皮に存在するタンパク質の発現も認められていることから(図3)、作製モデルは生体腸管上皮に類似した遺伝子発現パターンおよびタンパク質の発現を示しています。また、透過型電子顕微鏡観察の結果、作製モデルは1~1.5 μm(ヒト小腸と同程度)の微絨毛を有しており、構造的にもヒト小腸の特徴を備えています(図4)。さらに、CYP3A4の基質であるミダゾラムを用いた代謝活性評価の結果、作製モデルではCaco-2モデルよりも高活性のまま長期間維持されることを確認しており(課題③の解決、図5)、従来のCaco-2モデルでは難しかったとされる長期間にわたる薬剤の評価にも有用と考えられます。
以上の結果から、今回開発した培地を用いて培養したヒトiPS細胞由来腸管上皮モデルは、Caco-2モデルの課題(遺伝子発現、代謝機能)を克服しており、新規なin vitroモデルとしての活用が期待されます。
参考文献
1)西村友宏、薬剤学、67(6)、407-410 (2007)
2)家入一郎、臨床薬理、44(3)、268-272 (2013)
3)M.Shimizu, J. Jpn. Soc. Nutr. Food Sci., 56, 251-255(2003).
4)S.Ogaki et al., Sci. Rep., 5, 17297 (2015).
5)粂昭苑、薬剤学、78(4)、170-174 (2018)
6)粂昭苑、ファルマシア、55(6)、527-531 (2019)
7)S.Yoshida et al., Stem Cell Rep., 16, 1-14 (2021).
関連製品
関連リンク
研究発表
論文
- Generation of human-induced pluripotent stem cell-derived functional enterocyte-like cells for pharmacokinetic studies
S.Yoshida, T.Honjo, K.Iino, R.Ishibe, S.Leo, T.Shimada, T.Watanabe, M.Ishikawa, K.Maeda, H.Kusuhara, N.Shiraki, S.Kume
Stem Cell Reports, Vol.16, 1–14(2021).
学会発表
- 吸収腸上皮細胞への分化を促進する低分子化合物のスクリーニング
石部隆之介、Leo Sylvia、渡邊輝彦、白木伸明、粂昭苑
第20回日本再生医療学会総会、2021年
- コラーゲンビトリゲル膜と新規培地で培養したヒトiPS 細胞由来小腸細胞の有用性
渡邊輝彦、石川晶也、加藤祐介、石部隆之介、白木伸明、粂昭苑
第20回日本再生医療学会総会、2021年
お問い合わせ
製品に関する問い合わせ
試薬事業本部 バイオケミカル部
TEL :03(6214)1090
E-mail:bio-info[at]kanto.co.jp(アドレス入力時には[at]を@に変更してください)
研究開発に関する問い合わせ
技術・開発本部 技術・開発部
TEL :03(6214)1070
E-mail:td-info[at]kanto.co.jp(アドレス入力時には[at]を@に変更してください)



